Das war ein Fehler!

Die letzte Entscheidung ist leider gründlich daneben gegangen!

Die letzte Entscheidung ist leider gründlich daneben gegangen!

Du hast gewonnen, versuche dieses Spiel mehrfach erfolgreich durchzuspielen und lies dabei auch die auf jeder Seite verlinkten Infoseiten durch!
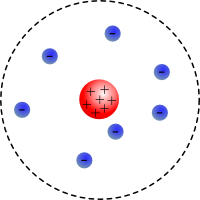
Du hast gerade im Jahre 1913 (unter Verwendung einer Zeitmaschine) mit Ernest Rutherford gesprochen, dem Begründer des Kern-Hülle-Modells.
Er hat Dir erklärt, dass sich fast die gesamte Masse des Atoms in dem sehr
kleinen Kern konzentriert und dass sich alle negativ geladenen Elementarteilchen
- die Elektronen - in der sehr großen Hülle befinden.
Leider kann er sich die Verteilung der Elektronen in der Hülle aber nicht erklären!
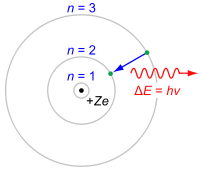
Noch im Jahr 1913 reist Du nach Dänemark und sprichst mit Niels Bohr. Dessen verfeinertes Atommodell, das Schalenmodell unterteilt die Hülle in bestimmte Energiestufen bzw. Schalen, auf denen sich die Elektronen bewegen. In seiner ursprünglichen Form wurde es aus den Spektrallinien für das Element Wasserstoff bestimmt.
Aus dem online-Periodensystem ergibt sich für das Element Lithium (Elementsymbol: Li) die folgende Anzahl:
| Symbol des Elementarteilchens | Anzahl | ergibt sich aus | Ort |
|---|---|---|---|
| p⁺ | 3× | Links unten dem Elementsymbol vorangestellte Protonenzahl | im Kern |
| n | 4× | Links oben dem Elementsymbol vorangestellte Gesamtnukleonen¹zahl 7 - Protonenzahl 3 | |
| Gesamt-e⁻ | 3× | Da ein Atom elektrisch neutral ist, genau gleich der Protonenzahl 3 | in der Hülle |
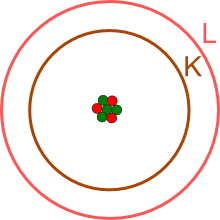
Die vier Neutronen dienen als Abstandhalter im Kern, um die Abstoßung der drei
positiv geladenen Protonen zu verringern.
Ein Blick ins
online-Periodensystem
zeigt, dass bei Lithium die K- und die L-Schale
(entsprechend den Hauptenergieniveaus mit n=1 und n=2) besetzt sind.
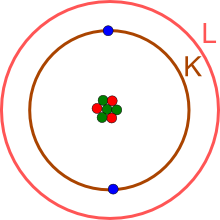
Das Lernprogramm zur Elektronenbesetzung zeigt, dass die innerste Schale (K-Schale, Hauptenergieniveau n=1) nur mit maximal zwei Elektronen besetzt werden kann.
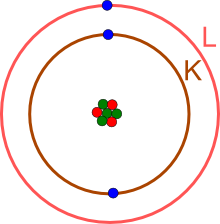
Das noch fehlende Elektron liegt auf der äußersten Schale, hier der L-Schale (Hauptenergieniveau n=2).
Die äußerste mit Elektronen besetzte Schale wird auch als
Valenzschale
bezeichnet.
Das auf der äußersten Schale liegende
Valenzelektron
bestimmt dann die chemischen Eigenschaften des jeweiligen Elements.
Nur die Valenzelektronen sind an
chemischen Bindungen
beteiligt.
⇒ Aus der Hauptgruppennummer - hier I - geht
(mit Ausnahme des Elements Helium He)
direkt die Zahl der Valenzelektronen hervor.